Redox-Reaktionen sind hier auch nichts Ungewöhnliches, und zum Glück können wir auch hier unsere bisher genutzten Regeln anwenden. Die Oxidationszahlen, die ja aus den Elektronegativitäten der Atome resultieren, werden bei organischen Substanzen wie üblich ermittelt.
Dem Sauerstoff wird die OZ=-II, dem Wasserstoff die OZ=+I zugeordnet.
Gleiche Atome beeinflussen sich nicht.
Du musst dann nur die Oxidationszahl des betrachteten Kohlenstoff-Atoms ausrechnen.
Eine andere Methode erscheint umständlicher, ich verwende sie aber lieber. Das ist eben Geschmacksache, beide Wege führen zum Ziel.
Grundlage sind hier auch die Elektronegativitäten : Da in organischen Substanzen nur wenige Atomsorten vorkommen, gestaltet sich die ganze Angelegenheit recht übersichtlich.
Du musst dir nur die einzelnen Elektronegativitäten der beteiligten Atome einprägen, dann kann schon nichts mehr schief gehen. Merke dir einfach die folgende Reihe:
| O | > | N | > | Cl | > | C | > | H |
| 3,5 | 3,1 | 2,8 | 2,5 | 2,1 |
Bei organischen Verbindungen finden Redox-Reaktionen immer am Kohlenstoff-Atom, welches die "funktionelle Gruppe" trägt, statt.
Daher musst du auch nur für dieses C-Atom die Oxidationszahl vor und nach der Reaktion bestimmen.
Die anderen bisher angewendeten Regeln besitzen immer noch ihre Gültigkeit. Übung 9: Ethanol reagiert im Sauren zu Essigsäure.
Zuerst erstellt man die Strukturformel des Eduktes und des Produktes links und rechts des Reaktionspfeiles:
 |
 |
Am besten machst du das mit Hilfe eines Stiftes:
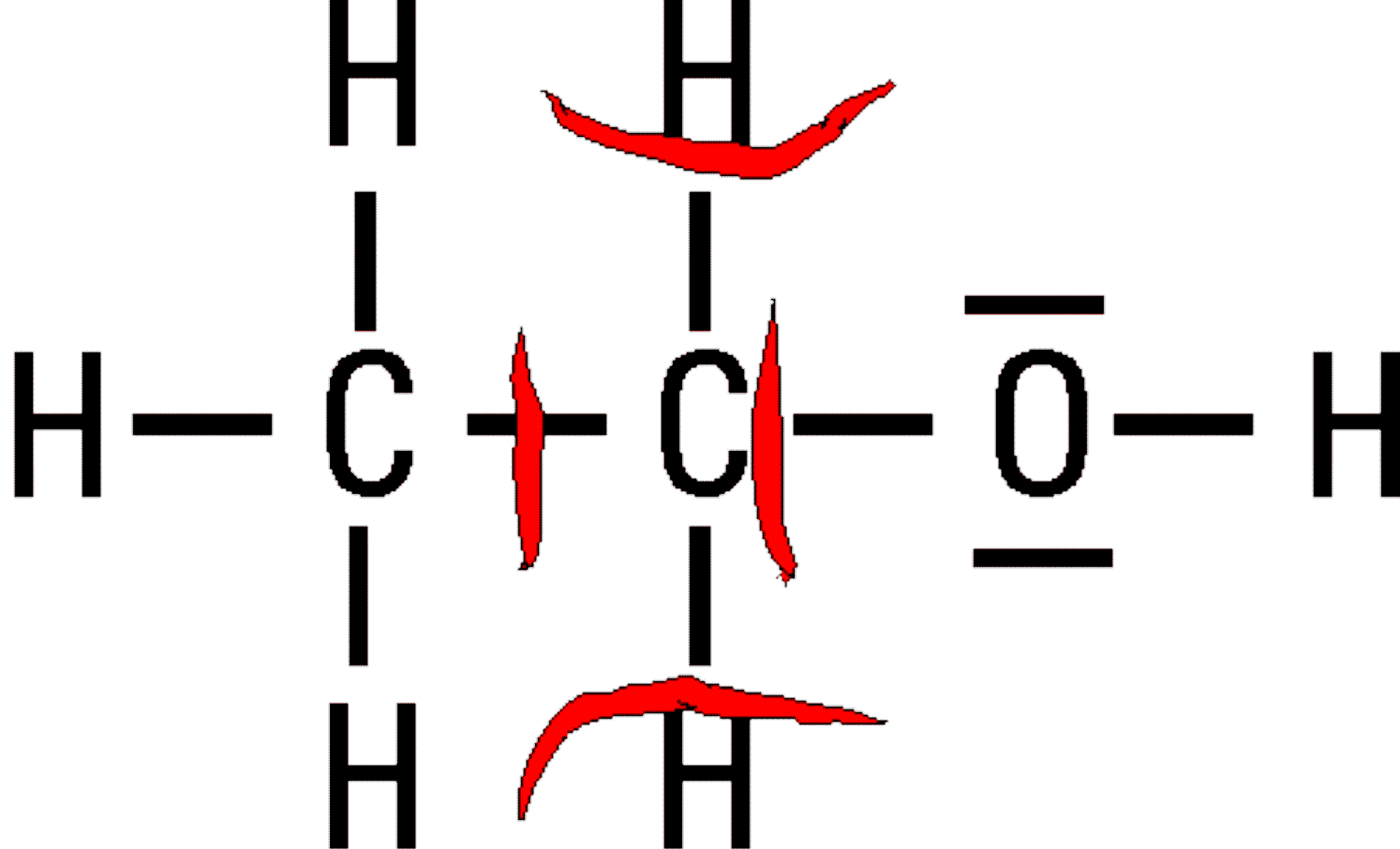 |
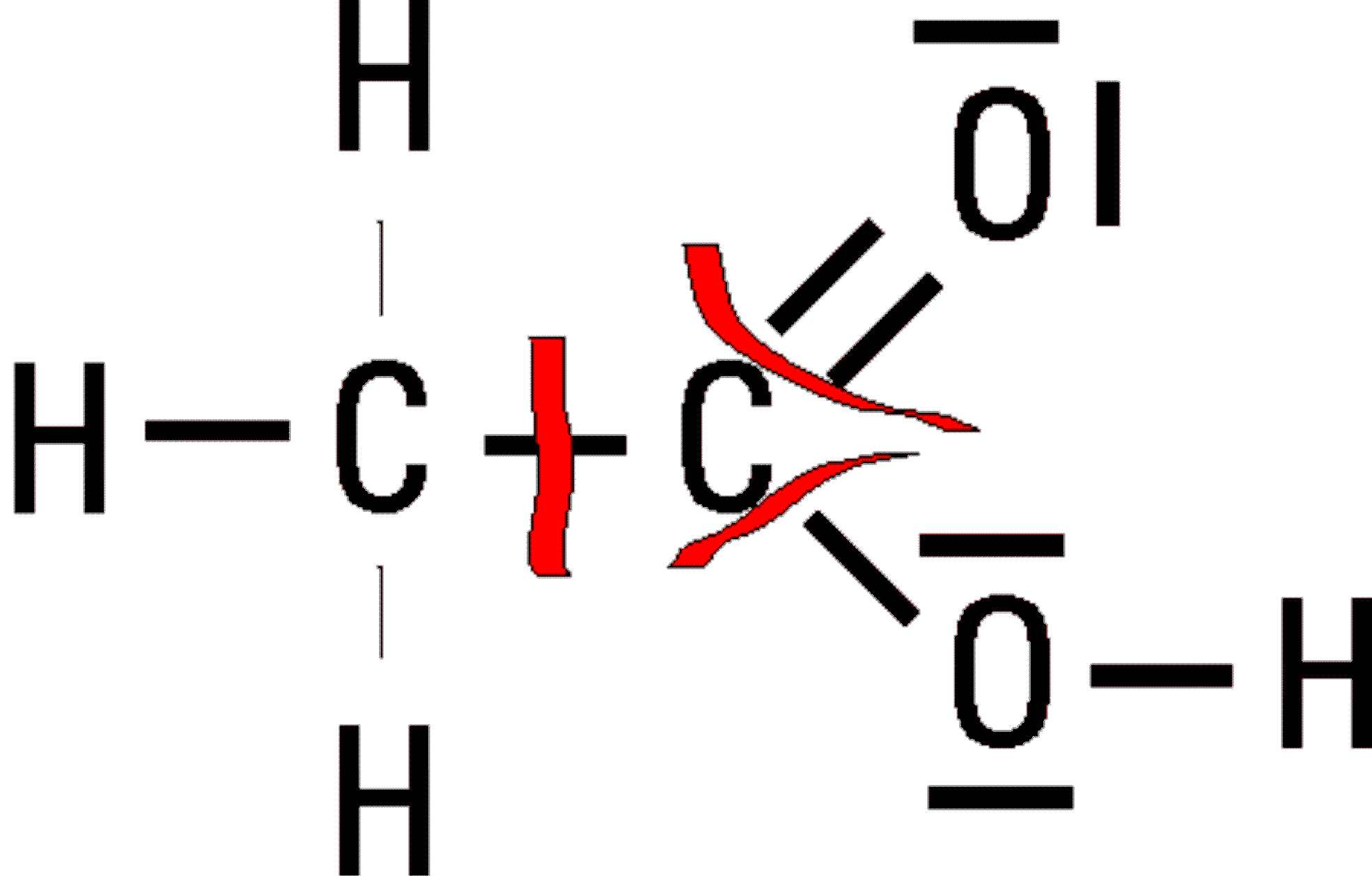 |
Zähle jetzt die dem betrachteten Atom (hier C-Atom) verbliebenen Elektronen und vergleiche diese mit seinen Valenzelektronen.
Das Kohlenstoff-Atom besitzt vier solcher Valenzelektronen.
Im Fall der Essigsäure (rechts!) wird ihm aber nur noch eines zugesprochen. Somit "fehlen" dem Atom eigentlich drei "Negative Elektronen".
Dieses Fehlen drückt sich in der Oxidationszahl "+III" aus ! Entsprechend kann man dem betrachteten Kohlenstoff-Atom im Ethanol (links!) die Oxidationszahl "-I" zuordnen.
Und jetzt geht es weiter wie bisher!
Bei der Reaktion von links nach rechts hat sich die Oxidationszahl um vier Werte erniedrigt.
Du solltest schon wissen, dass dies einer Abgabe von vier Elektronen entspricht, was wir in der Gleichung auch darstellen müssen:
| -I | +III | 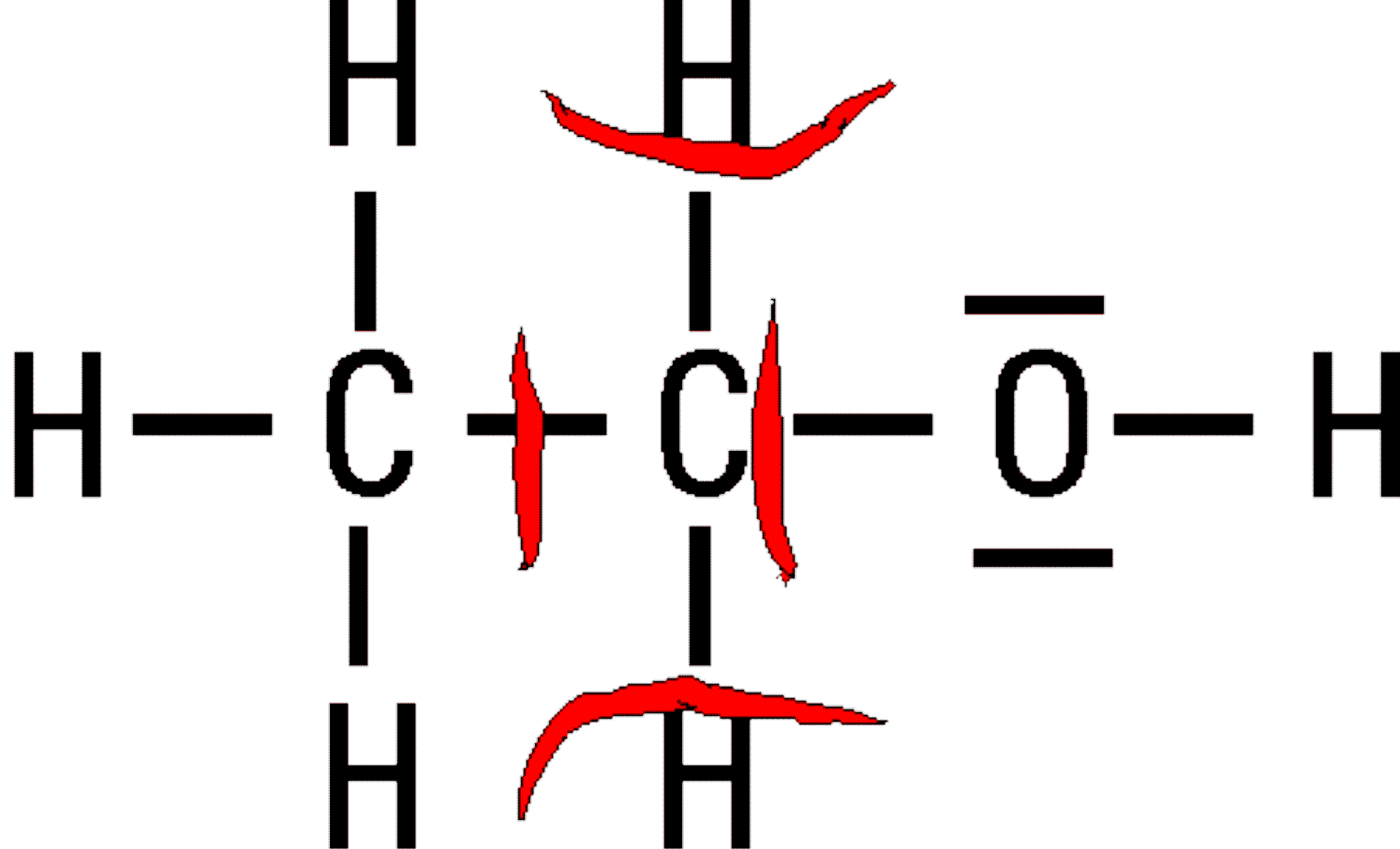 |
 |
+ | 4 e- |
Es handelt sich also um eine Oxidation, und wir können nun den Ladungsausgleich für die sauere Umgebung durchführen:
| Ox : | 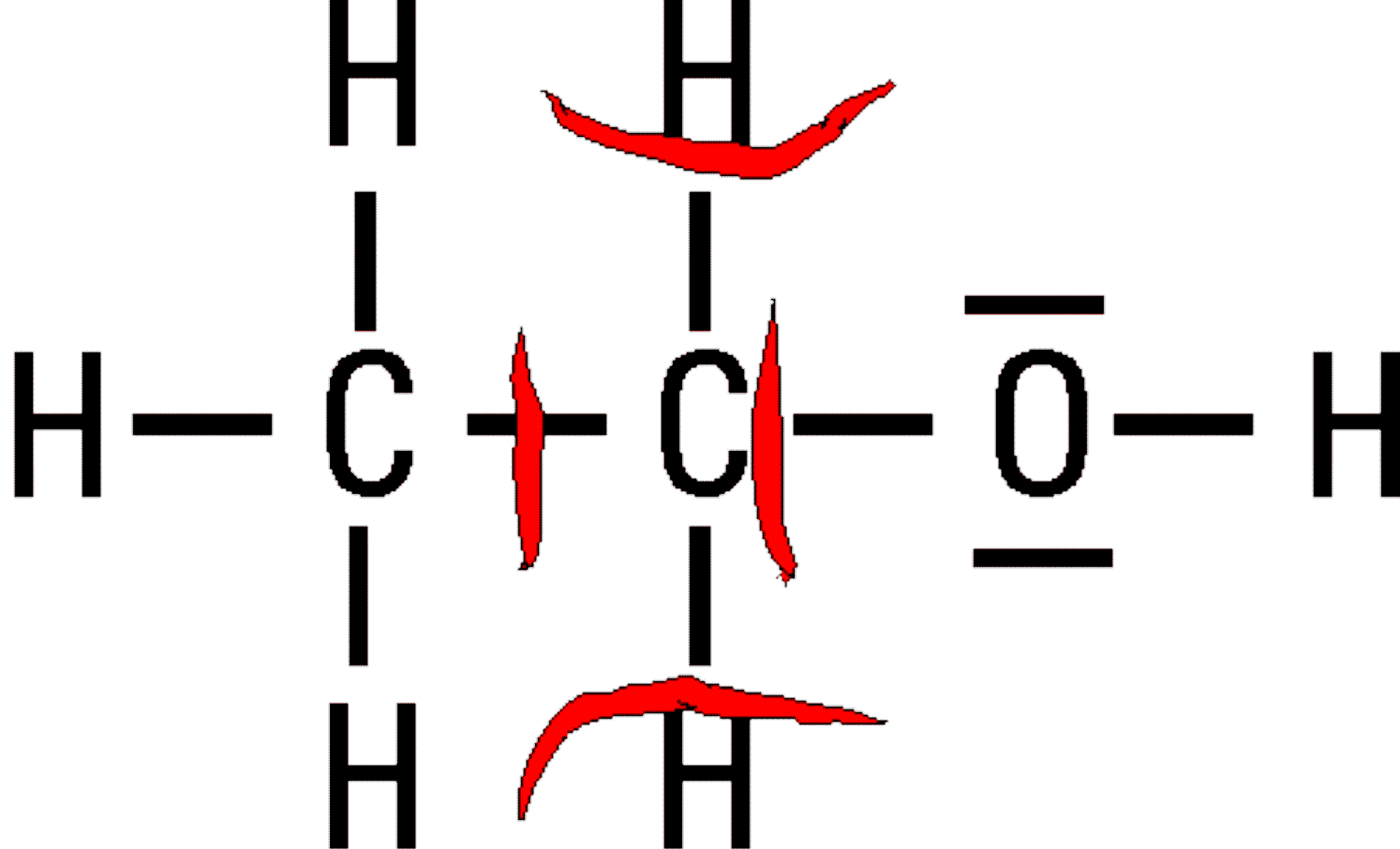 |
 |
+ | 4 e- | + | 4 H3O+ |
Nun fehlt noch der Stoffausgleich, und die Teilgleichung ist fertig :
| Ox : | 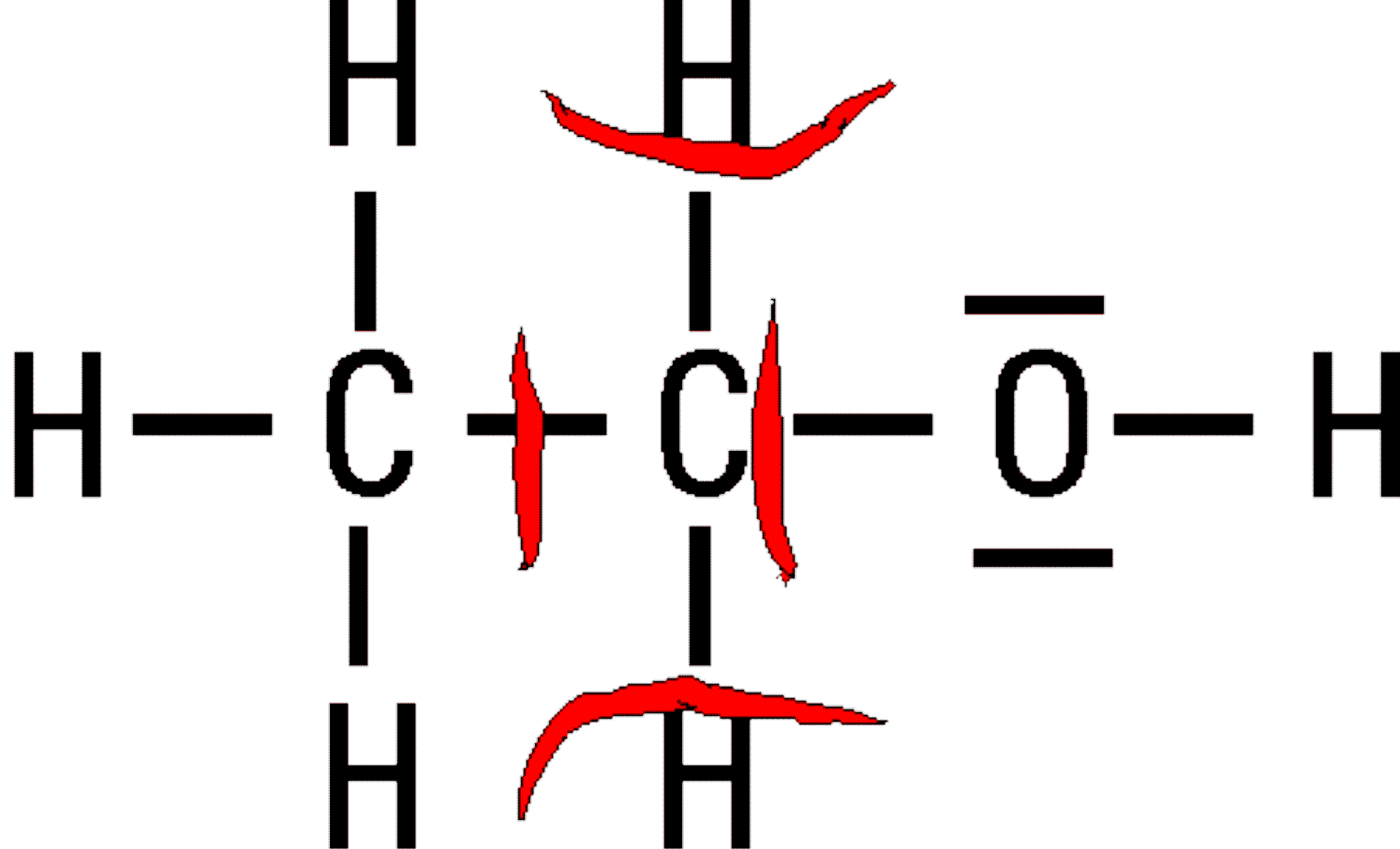 |
+ | 5 H2O |  |
+ | 4 e- | + | 4 H3O+ |
Die entsprechende Reaktion kannst du mit einem starken Oxidationsmittel wie Kaliumpermanganat, welches in Lösung Permanganat-Ionen bildet, erzwingen.Es wird hierbei zu Mangan-Ionen reduziert.
Vervollständige bitte die Redox-Gleichung !
Zur Lösung
Ethanol ist ein "primaerer Alkohol" und kann deshalb, mit starken Oxidationsmitteln, bis zur Carbonsäure oxidiert werden.
Unter geeigneten Bedingungen führt die Oxidation primärer Alkohole aber nur bis zur Stoffgruppe der "Aldehyde" die dann weiter zu Carbonsäuren oxidiert werden können.
Ethanol ist ein "primaerer Alkohol" und kann deshalb, mit starken Oxidationsmitteln, bis zur Carbonsäure oxidiert werden.
Unter geeigneten Bedingungen führt die Oxidation primärer Alkohole aber nur bis zur Stoffgruppe der "Aldehyde" die dann weiter zu Carbonsäuren oxidiert werden können.

